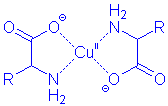
| Chelat-Komplexe von Aminosäuren |
Da bei den Anionen der Aminosäuren die Carboxyl- und die Aminogruppe dissoziiert sind, können
diese als Chelat-Liganden wirken. Stabile Komplexe werden mit vielen zweiwertigen Metall-Ionen gebildet,
besonders leicht bilden sich Kupfer-Komplexe:
Der linke Kolben enthält eine 0,1-molare Kupfersulfat-Lösung, in dieser liegt der
hellblaue [Cu(H2O)4]2+-Komplex vor. Der gleichkonzentrierten
Lösung im rechten Kolben wurde die Aminosäure Glycin zugegeben, es bildet sich der
tiefblaue Aminosäure-Komplex [Cu(Gly)2].
Bei den basischen Aminosäuren Lysin und Arginin ist die a-Aminogruppe auch in der zwitterionischen
Form dissoziiert, so daß hier auch das Zwitterion einen Kupfer-Chelatkomplex bilden kann. Die folgende
3D-Struktur zeigt den kationischen Kupferkomplex [Cu(Arg)2]2+, wie er in der Verbindung
[Cu(Arg)2][HgBr4] vorliegt.
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:58 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie