Bei der Ausbildung eines b-Faltblattes weisen benachbarte Peptidbindungen
in die entgegengesetzte Richtung. Ab der dritten Bindung wird die typische Anordnung deutlich.
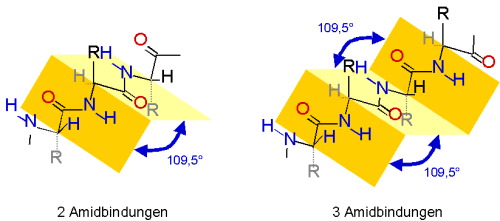
Stabilisiert wird das b-Faltblatt erst, wenn sich eine zweite Peptidkette
anlagert. Zwischen den beiden Kettenabschnitten bilden sich Wasserstoffbrücken aus. Ein
b-Faltblatt kann, im Gegensatz zur a-Helix,
nicht aus nur einem Strang bestehen.
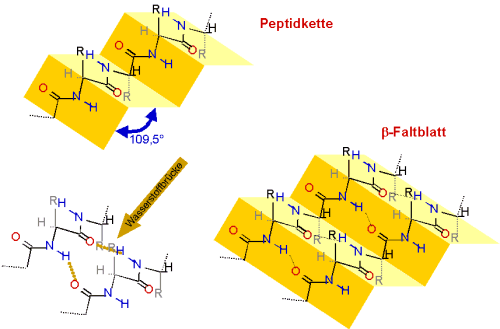
Die Ketten können aus der gleichen Peptid-Kette stammen (dies ist der Normalfall),
es können sich aber auch mehrere Peptide zu einem Faltblatt zusammenlagern.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

