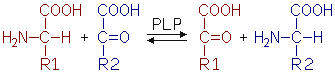
Beim Abbau vom Proteinen werden die Peptidbindungen durch Endo- und Exo-Peptidasen
hydrolytisch gespalten. Sollen die Aminosäuren weiter abgebaut werden, muß der
Organismus die Freisetzung von Ammoniak (NH3) verhindern, da Ammoniak ein
starkes Zellgift ist. Die meisten Aminosäuren werden daher zunächst transaminiert.
Bei diesem Prozeß, für den Pyridoxalphosphat (PLP) als Co-Substrat nötig ist,
wird die Aminogruppe auf eine a-Ketosäure (2-Oxosäure)
übertragen, wobei aus der Aminosäure eine a-Ketosäure
wird und aus der vorherigen a-Ketosäure eine Aminosäure.
Durch diesen Prozeß können nicht essentielle Aminosäuren für die Proteinbiosynthese
oder zur Erzeugung biogener Amine gewonnen werden, oder es werden Asparaginsäure und
Glutaminsäure gebildet, die in den Harnstoffzyklus eingeschleust
werden. Im Harnstoffzyklus erfolgt dann die eigentliche "Ammoniak-Entgiftung".


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie