Das Pauli-Prinzip besagt, daß jedes Orbital maximal 2 Elektronen
beinhalten kann, die den gleichen Energiewert, aber entgegengesetzten Spin
haben.
Die Regel von Hund beschreibt die Besetzung der Orbitale gleicher
Energie mit Elektronen. Demnach wird jedes energetisch gleichwertige Orbital
erst mit einem Elektron besetzt, und erst nachdem jedes dieser Orbitale ein
Elektron besitzt, erhält es ein zweites.
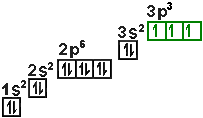
| Bsp: |
Phosphor |
Schwefel |
| |
 |
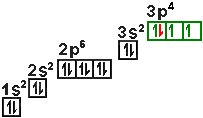 |
In unserem Beispiel werden beim Phosphoratom erst die einzelnen 3p-Orbitale
mit je einem Elektron besetzt, beim Schwefelatom wird dann ein 3p-Orbital
mit einem zweiten Elektronen besetzt.
Atome erreichen einen Idealzustand, wenn sie in der äußersten
Schale acht Elektronen haben (Oktettregel). Dieser Zustand ist bei
den Edelgasen erfüllt, man bezeichnet diese Besetzung auch als Edelgaskonfiguration
(s2p6-Konfiguration).
Um diese energetisch günstige Elektronenkonfiguration zu erreichen, bilden
die Elemente chemische Verbindungen (siehe Kap.
Chemische
Bindung).


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

