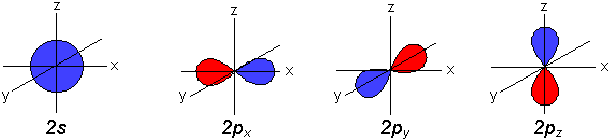Elektronen können nicht nur als Teilchen beschrieben werden, wie im
Bohrschen Atommodell; es ist auch eine mathematische Beschreibung als Welle
möglich.
Der Wellen-Charakter von Elektronen wird durch die Schrödinger-Gleichung
beschrieben. Sie gibt an, mit welcher Wahrscheinlichkeit sich ein Elektron
in einer bestimmten Entfernung zum Kern aufhält.
Durch diese Wahrscheinlichkeit wird für jedes Elektron ein bestimmter
Raum definiert, in dem es sich aufhält (Elektronendichteverteilung).
Diese Räume heißen Orbitale. Es gibt s-, p-,
d- und f-Orbitale.
Die s-Orbitale sind kugelsymmetrisch, in ihrem Zentrum liegt der Atomkern.
In der K-Schale (2 Elektronen) gibt es nur ein s-Orbital.
In der 2. Schale (L-Schale, max. 8 Elektronen) werden nach dem s-Orbital die
p-Orbitale besetzt. Es gibt drei verschiedene p-Orbitale. p-Orbitale sind
hantelförmig und liegen in Richtung der x-, y- und z-Achse. Sie sind
rotationssymmetrisch und alle drei energetisch gleichwertig.
Es gibt außerdem fünf d-Orbitale und sieben f-Orbitale, die allerdings
eine komplexere Raumstruktur haben.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie