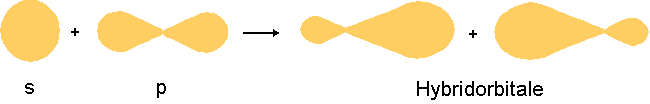Da Kohlenstoff für die organische Chemie eine besondere Rolle spielt,
soll an dieser Stelle genauer auf die Bindungsverhältnisse des Kohlenstoffatoms eingegangen werden.
Bindungen am Kohlenstoff sind Atombindungen.
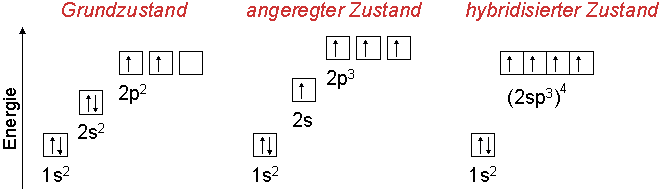
Das Kohlenstoffatom hat in seiner äußeren Schale 4 Elektronen (Elektronenkonfiguration: 2s2 2p2).
Davon liegen zwei Elektronen als Elektronenpaar (2s2) vor und zwei frei (2p2).
Das bedeutet, daß nur zwei Elektronen für Bindungen zur Verfügung stehen.
Allerdings würde dann die Oktettregel nicht erfüllt (höchstens 6 Elektronen).
Andererseits ist bekannt, daß Kohlenstoff vierbindig ist (Bsp: CH4).
Dies wird folgendermaßen erklärt:
Die Valenzelektronen reorganisieren sich so, daß vier Elektronen für Bindungen zur Verfügung stehen.
Das 2s- und die 2p-Orbitale verbinden sich zu vier sp3-Hybridorbitalen, die energetisch gleichwertig sind.
(sp3 bedeutet, daß an diesen Hybridorbitalen ein s- und drei p-Orbitale beteiligt sind.)
 |
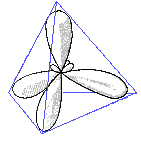
Die elektronische Verteilung der Hybridorbitale stellt man sich ungefähr so vor:
Die 4 sp3-Hybridorbitale ordnen sich im Raum so an, daß sie möglichst weit voneinander entfernt sind.
Dies wird durch eine tetraedrische Anordnung erreicht.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie