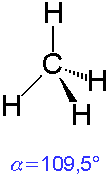
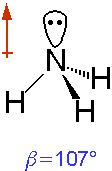
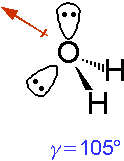Hybridisierung findet nicht nur beim Kohlenstoffatom statt.
Auch Stickstoff und Sauerstoff sind sp3-hybridisiert, obwohl sie nur 3- bzw. 2-bindig sind.
In diesen Fällen werden die sp3-Hybridorbitale mit bindenden oder freien Elektronenpaaren besetzt.
Dementsprechend sind die Orbitale von Ammoniak und Wasser auch im Tetraeder angeordnet,
allerdings erscheinen sie durch die freien Elektronenpaare wie eine Pyramide bzw. ein gewinkeltes Molekül.
In die schematischen Darstellungen der Moleküle sind die Dipolmomente eingezeichnet:
Wenn Stickstoff- und Sauerstoffatome Doppelbindungen eingehen, bilden sich π-Bindungen aus.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie