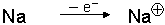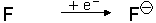Wenn Atome Elektronen aufnehmen oder abgeben, entstehen Ionen.
Kationen sind Ionen mit positiver Ladung, sie haben also Außenelektronen abgegeben.
Anionen nehmen im Gegenzug Elektronen in ihre äußerste Schale auf und sind negativ geladen.
Die Kernladungszahl ändert sich jedoch nicht.
| Kationen: |
Anionen: |
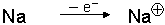 |
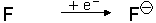 |
Durch die geringe Masse von Elektronen ändert sich die Atommasse bei der Ionenbildung nicht wesentlich.
Nicht jedes Atom hat die selbe Neigung zur Bildung von Ionen.
Elemente mit hohen Elektronegativitäten ziehen Elektronen stark an, sie bilden also bevorzugt Anionen.
Elemente mit niedrigen Elektronegativitätswerten dagegen bilden Kationen.
Ionenbindungen treten vor allem zwischen Elementen mit hoher Elektronegativitätsdifferenz auf.
Elemente mit ähnlichen Elektronegativitäten gehen bevorzugt kovalente Bindungen ein.
| Beispiel: |
| NaCl |
Na: 0.93 |
Cl: 3.16 |
Differenz: 2.23 |
Ionenbindung |
| CH4 |
C: 2.55 |
H: 2.20 |
Differenz: 0.35 |
kovalente Bindung |
 |
MC-Frage zur Ionenbildung |