Carbonsäurederivate weisen viele Gemeinsamkeiten mit Aldehyden und Ketonen auf.
- Das Carbonyl-C-Atom kann durch Nucleophile angegriffen werden.
- Das Carbonyl-O-Atom kann durch starke Säuren protoniert werden. Die
Polarisierung der C=O-Bindung wird verstärkt und nucleophile Angriffe
erleichtert.
- Starke Basen können ein Proton des a-ständigen
C-Atoms abspalten. Das Carbonsäurederivat wird dadurch zum Nucleophil,
das am a-C-Atom reagiert.
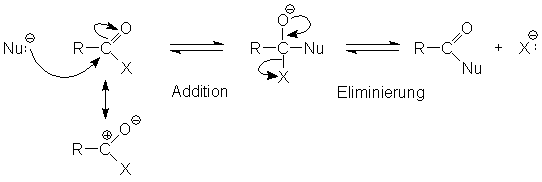
Der entschiedende Unterschied zwischen Aldehyden (bzw. Ketonen) und Carbonsäurederivaten
besteht in der Möglichkeit die Abgangsgruppe X zu eliminieren, sodass formal eine Substitutionsreaktion stattfindet. Erstere
spalten zwar bei der Acetalbildung oder bei der Aldolkondensation Wasser ab,
aber es können keine Reste eliminiert werden. Wie weit die oben dargestellte
Reaktion abläuft, hängt davon ab wie leicht sich X eliminieren lässt.
Die Eliminierbarkeit sinkt in folgender Reihenfolge: –Cl > –OCOR'
> –SR' > –OR' > –NH2
 Übungsaufgabe zur Reaktivität von Carbonsäurederivaten
Übungsaufgabe zur Reaktivität von Carbonsäurederivaten


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
