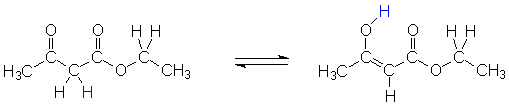Acetessigester steht in wässriger Lösung im Gleichgewicht mit seinem Enol,
wobei etwa 7,5% der Ester-Moleküle in der Enol-Form vorliegen.
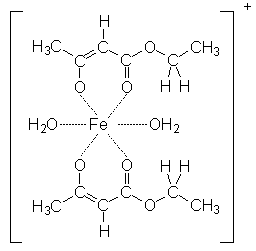
Das Enol bzw. das Enolat-Ion kann mit Fe3+-Ionen rotviolette Chelat-Komplexe bilden:
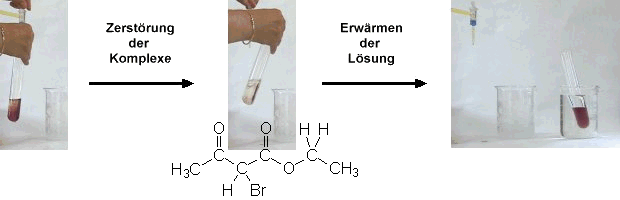
Im Video wird zu einer durch die Komplexe gefärbten Lösung Bromwasser
zugegeben. Brom wird an die C=C-Doppelbindung des Enols addiert.
Dadurch wird der farbige Komplex zerstört und die Lösung entfärbt.
Wird die Lösung in einem Wasserbad erwärmt stellt sich schnell wieder
das Keto-Enol-Gleichgewicht ein. Es werden wiederum Chelat-Komplexe mit den
Eisen-Ionen gebildet und die Lösung nimmt wieder die ursprüngliche
Färbung an.
 Keto-Enol-Tautomerie
Keto-Enol-Tautomerie
In gekühlter Lösung kann dagegen der "Aktivierungsberg" nicht so
leicht überwunden werden (Arrheniusgleichung). Die aus dem Gleichgewicht
entfernten Enol-Moleküle werden nicht aus der Keto-Form nachgebildet. Wird
der Versuch quantitativ durchgeführt, z.B. durch Titration mit einer eingestellten
Brom-Lösung, kann aus dem Verbrauch der Enol-Gehalt berechnet werden. Dabei
muß die Lösung aber auf -10°C abgekühlt und die Addition bei dieser Temperatur
durchgeführt werden.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie