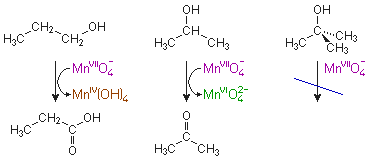
Primäre, sekundäre und tertiäre Alkohole können unterschiedlich leicht
oxidiert werden.
Während der primäre Alkohol 1-Propanol (n-Propanol) bis zur Propionsäure
oxidiert werden kann, endet die Oxidation des sekundären 2-Propanols (Isopropylalkohol)
beim Keton. Tertiäres Butanol (2-Methyl-2-propanol) kann von den meisten Oxidationsmitteln
nicht angegriffen werden.
Im folgenden Versuch werden diese Alkohole zu einer Permanganat-Lösung gegeben.
Bei 1- und 2-Propanol tritt sofort eine Grünfärbung auf, bei 1-Propanol schlägt die
Farbe innerhalb einer Minute nach braun um. Bei tert. Butanol zeigt sich keine Farbänderung.
Das violette Permanganat - in diesem besitzt Mangan die Oxidationsstufe +VII - wird von 1-Propanol
über das grüne Manganat(VI) zu braunem Mangan(IV)hydroxid (Mn(OH)4) reduziert.
Die Abbildung zeigt eine Projektion des Ergebnisses.
 Oxidation von Alkoholen
Oxidation von Alkoholen


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie