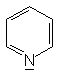
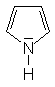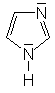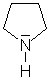Während aliphatische Amine starke Basen sind, gilt dies für
aromatische Amine nicht grundsätzlich. Ist das Elektronenpaar
am Stickstoff in das aromatische System eingebunden, (z.B. beim Pyrrol)
kann das Molekül nicht als Base wirken. Auch wenn ein freies Elektronenpaar
vorhanden ist (Pyridin, Imidazol) ist die Basenstärke aromatischer
Amine deutlich geringer als die nicht-aromatischer Amine (Pyrrolidin).
| Basenstärke von Heterocyclen |
 |
<< |
 |
< |
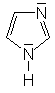 |
<< |
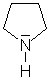 |
| Pyrrol |
|
Pyridin |
|
Imidazol |
|
Pyrrolidin |
Da Stickstoff eine höhere Elektronegativität besitzt als Kohlenstoff,
sind die p-Systeme der Heteroaromaten elektronenärmer als Benzol.
Sie zeigen daher auch eine geringere Reaktivität.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie