Die FISCHER-Projektion mit der
D,L-Nomenklatur wird insbesondere bei Aminosäuren und
Zuckern angewandt und ist hier auch zweckmäßig. Bei vielen Substanzen, insbesondere
dann, wenn mehrere Heteroatome (d.h. nicht C oder H) an ein Kohlenstoffatom gebunden sind,
ist die D,L-Nomenklatur nicht anwendbar. Für diese Fälle wurde von CAHN,
INGOLD und PRELOG die R,S-Nomenklatur
für die absolute Konfiguration eingeführt.
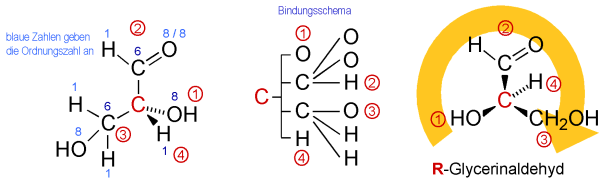 |
Zunächst wird für die Substituenten eine "Rangordnung" aufgestellt, deren Grundlage
die Ordnungszahl liefert. Je höher die Ordnungszahl, desto höher die Priorität.
In unserem Fall: O = 8 = höchste Priorität (1), H = 1 = niedrigste Priorität (4),
C = 6 kommt 2x vor. Die beiden C-Atome werden nun nach deren Bindungspartnern unterschieden.
Gibt es hier Unterschiede in der Ordnungszahl, hat wiederum die höhere Priorität.
Sind in beiden Gruppen die gleichen Atome enthalten, wird die Summe gebildet,
wobei doppelt gebundene Atome doppelt zählen: -CHO = 2 x 8 + 1 = 17, -CH2OH
= 8 + 2 x 1 = 10. Die Aldehydgruppe ist somit höherrangig als die CH2OH-Gruppe.
® -CHO = (2), -CH2OH = (3).
Nun wird das Molekül so gedreht, daß der
Substituent mit der niedrigsten Priorität (4) - in unserem
Beispiel der Wasserstoff - nach hinten weist, die
drei übrigen Substituenten zeigen dann nach vorn.
Beschreibt man nun einen Kreis, ausgehend von (1) über (2) nach (3), so kann dieser
rechts = in Uhrzeigerrichtung oder links
herum = gegen den Uhrzeigersinn verlaufen. Läuft er im Uhzeigersinn
bezeichnet man die Konfiguration mit R (von lat. rectus
= rechts), im anderen Fall mit S (lat. sinister = links).
D-Glycerinaldehyd besitzt R-Konfiguration. Aufgrund der unterschiedlichen Konventionen müssen
sich D- und R-Formen nicht grundsätzlich entsprechen!
Der R,S-Deskriptor muß für jedes Chiralitätszentrum angegeben werden.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
