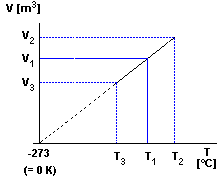 |
|
Das Verhalten von Gasen läßt sich relativ einfach untersuchen.
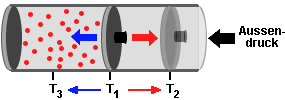
Als Beispiel betrachte man ein gasdichtes System aus einem Zylinder und
einem reibungslos beweglichen Stempel. Der Zylinder enthält eine
bestimmte Menge n Gasmoleküle mit der Temperatur T1
und dem Volumen V1.
Heizt man den Zylinder auf, wird der Stempel nach außen gedrückt.
Kühlt man ihn ab, wird der Stempel durch den nun höhern Außendruck
nach innen gedrückt. Der Druck p und die Stoffmenge n
des Gases bleiben dabei konstant. |
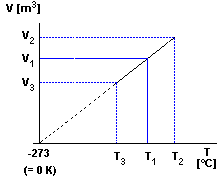 |
|
Trägt man das Volumen des Gases gegen die Temperatur auf, zeigt
sich, daß das Volumen proportional zur Temperatur ist: V ~ T
Extrapoliert man diese Gerade auf tiefe Temperaturen, schneidet sie
die Abszisse bei - 273,15 °C bzw. bei 0 K (Kelvin) dem
absoluten Nullpunkt der Temperaturskala . 0 °C entsprechen
einer absoluten Temperatur von 273,15 K.
|
In weiteren Versuchen läßt sich zeigen, daß
bei konstanter Temperatur und Stoffmenge: V ~ 1/p
bei konstantem Druck und konstanter Temperatur: V ~ n
gelten.
Diese drei Beziehungen lassen sich in der Zustandsgleichung
idealer Gase zusammenfassen:
p · V = n · R · T
p = Druck [Pa = N/m2] oder [bar]
V = Volumen [m3] oder [l]
n = Stoffmenge [mol]
R = allgemeine Gaskonstante [8,31 J/mol·K] oder [0,0831 l·bar/mol·K]
T = absolute Temperatur [K]
Das Volumen, das ein Mol Gasteilchen bei Normalbedingungen
(273,15 K und 1,013 bar) einnimmt, wird als Molvolumen
bezeichnet. Setzt man die Werte der Normalbedingungen in die Zustandsgleichung ein, erhält
man ein Volumen von 22,4 l/mol: das Molvolumen eines idealen
Gases. Gase verhalten sich ideal, wenn das Volumen der Teilchen
und die Wechselwirkungsenergie zwischen den Teilchen vernachlässigbar
klein sind. Dies trifft in erster Näherung zu, solange die Temperatur
deutlich über dem Siedepunkt liegt.
 Physikums-Frage zu idealen Gasen
Physikums-Frage zu idealen Gasen


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie