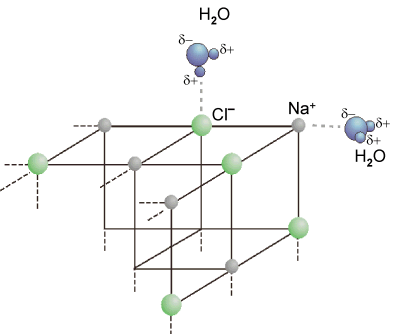
Beim Lösen eines Salzes wird der Kristallverband aufgebrochen. Wassermoleküle
lagern sich an die Ionen an, die Ionen werden hydratisiert. Die Abbildung zeigt
das Anlösen eines Kochsalz-Kristalls. Die Wassermoleküle werden durch elektrostatische
Kräfte angezogen, wobei sich die Moleküle mit dem negativ polarisierten Sauerstoff an
die positiv geladenen Natriumionen anlagern, oder mit ihrer positiv polarisierten Seite
an die negativ geladenen Chloridionen.
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:41:26 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie