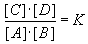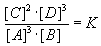Chemische Gleichgewichte werden durch das Massenwirkungsgesetz beschrieben.
Nachdem sich das Gleichgewicht eingestellt hat, ändern sich die Konzentrationen
der einzelnen Reaktionspartner nicht mehr. Bildet man den Quotienten aus dem Produkt der
Konzentrationen der Produkte und dem der Edukte, ergibt sich die Gleichgewichtskonstante K.
A + B  C + D
C + D
Das Massenwirkungsgesetz:
Die Gleichgewichtskonstante nimmt für jede Reaktion eine charakteristische Größe
an. Ist sie sehr groß, liegt das Gleichgewicht sehr weit auf der Seite der Produkte,
die Rückreaktion findet kaum statt. Geht K gegen null, liegt das
Gleichgewicht auf der Seite der Edukte. Die Gleichgewichtskonstante ist von den Konzentrationen
unabhängig, sie ist aber temperaturabhängig. Durch Temperaturänderung können
Gleichgewichte verschoben werden.
Die stöchiometrischen Koeffizienten erscheinen im Massenwirkungsgesetz als Exponenten
der jeweiligen Konzentrationen:
3 A + B  2 C + 3 D
2 C + 3 D
= A + A + A + B  C + C + D + D + D
C + C + D + D + D


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 C + D
C + D