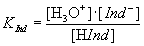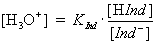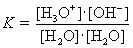| Zur Messung des pH-Werts sind verschiedene Methoden entwickelt worden: |
 |
|
 |
| 1. |
Verwendung
von Indikatoren oder von Indikatorpapier |
|
2. |
Messung
pH-abhängiger, elektrochemischer Potentiale mit Hilfe von pH-Metern
|
| Indikatoren sind Farbstoffe, deren Farbe in Lösung
vom pH-Wert abhängt (z.B. das bereits vorgestellte Rotkohlextrakt).
Ändert sich der pH-Wert, reagieren sie mit einem deutlichen Farbumschlag.
Wirkungsweise: |
| · |
Indikatoren sind organische Säuren oder Basen, wobei ein undissoziiertes
Indikatormolekül eine andere Farbe hat als seine konjugierte Base
oder Säure. |
| · |
Indikatoren weisen in Lösung eine intensive Farbe auf. Es wird
also nur eine geringe Stoffmenge davon benötigt, und der pH-Wert
der Probenlösung wird durch die Säure-Base-Eigenschaften des
Indikators praktisch nicht beeinflusst. |
Gleichgewichtsreaktion eines Indikators (Undissoziierte Säure: HInd; konjugiertes Base: Ind– ):
|
| Eine hohe H3O+-Ionen-Konzentration drängt
das Gleichgewicht nach links; die Konzentration der HInd-Moleküle
überwiegt und deren Farbe wird sichtbar. Umgekehrt lässt sich
durch Zugabe von OH–-Ionen das Gleichgewicht nach rechts verschieben;
die Farbe der Ind–-Moleküle wird sichtbar. |
Auch hier gilt das Massenwirkungsgesetz:
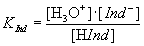 |
; |
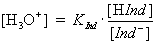 |
|
| Durch Logarithmieren erhält man: |
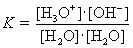 |
|
Liegt gleich viel HInd wie Ind– vor, bildet sich eine Mischfarbe.
Nach obiger Formel gilt für diesen Zustand pH = pKInd .
Der für einen bestimmten Indikator charakteristische pH-Wert wird der
Umschlagspunkt des Indikators genannt.
Damit die Farben eines Indikators deutlich unterscheidbar sind, muss ungefähr
10 mal soviel HInd wie Ind– vorliegen oder umgekehrt. Als
Faustregel gilt deshalb:
| Umschlagsbereich: |
pH = pKInd
± 1 |
Durch die Wahl eines Indikators mit passendem pK-Wert, lässt sich aussagen,
ob der pH einer Lösung über oder unter einem bestimmten Wert liegt.
Die Indikatormethode hat nicht die Genauigkeit und die Möglichkeiten
eines pH-Meters, aber für viele Anwendungen ist sie sehr praktisch.
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:55 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie