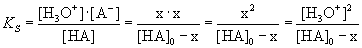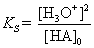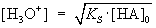| Berechnung
des pH-Wertes schwacher Säuren |
|
| Schwache Säuren |
Eine schwache Säure dissoziiert nur zu einem geringen Teil zu H3O+
und A– (Gleichgewicht auf linker Seite).
| HA + H2O |
 |
H3O+ + A– |
|
Kennt man die Konzentration der Säure, die zu Beginn der Reaktion vorlag ([HA]0),
lässt sich daraus die gesuchte Grösse [H3O+] berechnen:
| – |
Aus jedem dissoziierten HA entstehen je ein H3O+
und ein A– ([H3O+] = [A–] = x) |
| – |
Die Konzentration der nicht dissoziierten Säure HA beträgt im Gleichgewicht [HA]0 – x |
|
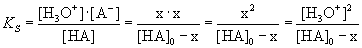 |
| Da bei schwachen Säuren nur ein geringer Anteil der Säure
dissoziiert, gilt [HA]0 –x »
[HA]0. Einsetzen in die Gleichung ergibt: |
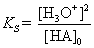
|
umformen ® |
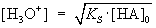
|
logarithmieren ® |
| a) für schwache Säuren: |
pH = ½(pKS
- log[HA]0) |
| b) durch analoges Vorgehen für schwache Basen: |
pH = 14 - ½(pKB
- log[B]0) |
 Physikum-Frage zum pH-Wert von Lösungen verdünnter Säuren
Physikum-Frage zum pH-Wert von Lösungen verdünnter Säuren
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:54 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie