Transform, Retron, Strategische Bindung und Synthon
Jede Operation, die während einer retrosynthetischen Analyse in Umkehr
einer chemischen Reaktion aus dem Reaktionsprodukt Edukte herleitet, wird als
Retroreaktion oder Transform bezeichnet.
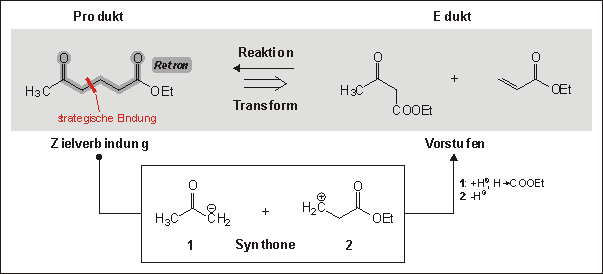
Eine Retroreaktion oder Transform am Beispiel der Michael-Reaktion als Gegenrichtung
einer chemischen Reaktion. Aus retrosynthetischer Sicht wird die Zielverbindung
in Vorstufen umgewandelt, was in Syntheserichtung der Umsetzung der Edukte zum
Produkt entspricht. Nachdem ein bestimmtes Retron die Anwendung des entsprechenden
Transforms signalisiert, erfolgt die Ableitung der Vorstufen durch Bruch einer
strategischen Bindung, wodurch zunächst Synthone entstehen. Diese werden
in Vorstufen umgewandelt.
Für die Anwendung eines Transforms müssen folgende Schritte durchgeführt
werden:
- In der Zielverbindung wird nach einem Retron gesucht. Unter einem Retron
wird eine bestimmte Schlüsselstruktur verstanden, die die Anwendbarkeit
des entsprechenden Transforms signalisiert.
- Strategische Bindungen werden in der Zielverbindung definiert. Eine strategische
Bindung zeichnet sich dadurch aus, daß sie aus retrosynthetischer Sichtweise
gebrochen wird. Das kann bedeuten, daß ihr Bruch zu einer großen
strukturellen Vereinfachung oder auf schon verfügbare Vorstufen (Ausgangsmaterialien)
führt. Als weitere Möglichkeit kann einem Bindungsbruch in Syntheserichtung
eine bekannte, breit anwendbare Reaktion zugrunde liegen, die die Umsetzung
der durch den Bindungsbruch abgeleiteten Vorstufen zum Produkt sicherstellen
würde.
- Alle spezifischen Transformationen, die notwendig sind um die strategische
Bindung zu brechen, werden ausgeführt.
Ist eine strategische Bindung gebrochen worden, entstehen Fragmente, die die
(denkbar) reagierenden Intermediate in einer Reaktion darstellen. Diese Fragmente
werden Synthone genannt. Da in den meisten Fällen der Bindungsbruch heterolytisch
erfolgt, ist ein Synthon meistens ein geladenes Fragment und entspricht noch
keiner konkreten Vorstufe. Um aus einem Synthon ein stabiles Molekül bzw.
eine tatsächlich verfügbare Vorstufe ableiten zu können, werden
in geeigneter Weise Atome, Ionen oder Atomgruppen hinzugefügt oder entfernt.
Der Bruch einer strategischen Bindung unter gleichzeitiger Ableitung von Synthesevorstufen
definiert einen denkbaren Reaktionsschritt auf die Zielverbindung zu. Im einfachsten
Fall entspricht dieser Reaktionsschritt einer bereits bekannten Reaktion aus
der Literatur. Meistens aber wird dieser Reaktionsschritt verallgemeinert werden
müssen, um nach bereits durchgeführten Reaktionen suchen zu können,
die dem gleichen oder einem vergleichbaren Reaktionstyp angehören. Eine
Möglichkeit, dies zu tun, ist, das Reaktionszentrum bzw. die Reaktionssubstruktur
der Reaktion zu identifizieren.
© Prof. Dr. J. Gasteiger, Dr. Th. Engel, M. Sitzmann, CCC Univ. Erlangen, Thu Apr 22 13:31:24 2004 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
