HYBOT Deskriptoren
Wechselwirkung zwischen Wasserstoff-Bindungs Donoren und Akzeptor-Gruppen
in verschiedenen Molekülen spielen eine Schlüsselrolle
bei vielen chemischen und biologischen Fragestellungen. Wasserstoffbrücken-Bindungen
können mit quantenmechanischen Methoden und empirischen Methoden
studiert werden. Ab-initio Methoden erlauben hierbei eine recht
genaue Berechnung der Energie und der geometrischen Struktur von
kleinen Molekülen. Raevsky et al. entwickelten einen Ansatz,
HYBOT (Hydrogen Bond Thermodynamics), um Wasserstoff-Bindungen quantitativ
mit empirischen Korrelationstechniken zu beschreiben. Dabei wird
die Thermodynamik der Ausbildung von Wasserstoff-Bindungskomplexen
berücksichtigt. Die HYBOT Deskriptoren basieren auf 135.000
thermodynamische Messungen von Wasserstoff-Bindungssystemen die
in einer Datenbank agbelegt sind.
Die relative Protonen-Akzeptor und Protonen-Donor Stärke von
Verbindungen werden durch Gebrauch von normalen Wasserstoff-Bindungen
abgeschätzt.
Die freie Energie DG und die Enthalpie
DH der Ausbildung von Wasserstoff-Bindungskomplexe
ist:
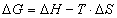
Wobei DS die Entropie
der Komplexbildung und T die Temperatur in Kelvin ist.
DG und DH
kann durch eine multiplikative Funktion der Wasserstoff-Bindung
in verschiedenen polaren und unpolaren Lösungen ausgedrückt
werden. Diese sind Faktoren von Enthalpie-Akzeptor Ea,
Enthalpie-Donor Ed, freier Energie-Akzeptor Ca
und freier Energie-Donor Cd (wobei k1,
k2 und k3 [kJ/mol]) Regressionskoeffizient
sind).
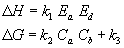
Ca und Cb werden aufgrund experimenteller
Werte von DG abgeschätzt.
Als Referenzstandard wird Phenol-Hexamethylphosphorsäuretriamid
(Phenol-HMPA) in CCl4 gewählt. Die freien Energiefaktoren
der Wasserstoff-Bindung, Cb und Ca,
wurden auf ~2.50 (Phenol) bzw. 4.00 (HMPA) gesetzt. HYBOT Deskriptoren
werden erfolgreich angewandt um den Verteilungskoeffizienten logP
(n-Oktanol-Wasser) für kleine organische Moleküle
mit einer Akzeptor-Gruppe vorherzusagen. Dabei werden Polarisierbarkeit,
der Faktor des freien Energie-Akzeptors Ca als
auch Eigenschaften der Löslichkeit logS, Permeabilität
von Medikamenten (Caco-2, menschliche Haut) berechnet und biologischer
Aktivitäten modelliert.
- O.A. Raevsky, V.Y. Grigor'ev, D.B. Kireev, N.S. Zefirov, Quant.
Struct.-Act. Relat. 1992, 11, 49-63
- O.A. Raevsky, V.Y. Grigor'ev, D.B. Kireev, N.S. Zefirov, J.
Chim. Phys. 1992, 89, 1747-1753
- O.A. Raevsky, Hydrogen Bond Strength Estimation by means
of HYBOT. In H. van de Waterbeemd, B. Testa, G. Folkers, Eds.,
Computer-Assisted Lead Finding and Optimization, Wiley-VCH,
Weinheim, 1997, pp. 367-378
© Prof. Dr. J. Gasteiger, Dr. Th. Engel, CCC Univ.
Erlangen, Wed Jun 9 12:55:24 2004 GMT
 BMBF-Leitprojekt
Vernetztes Studium - Chemie BMBF-Leitprojekt
Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt
Vernetztes Studium - Chemie
BMBF-Leitprojekt
Vernetztes Studium - Chemie