 |
Lactatdehydrogenase (LDH) |
Nomenklatur
- Oxidoreduktasen E.C. 1.-.-.-
- CH-OH-Gruppen-spezifisch E.C. 1.1.-.-.
- Benutzen NAD/NADP als Elektronenakzeptor E.C. 1.1.1.-
- LDH E.C. 1.1.1.27 : Größe 140kD, Tetramer aus 4 Untereinheiten
Allgemeine Reaktion
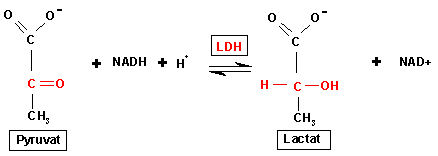
Das Enzym Lactatdehydrogenase nimmt eine zentrale Funktion beim anaeroben Stoffwechsel ein. Es katalysiert die Reduktion von Pyruvat zu Lactat; der Zweck dieser Umwandlung ist die Regenerierung des Elektronencarriers NAD+. Die Reaktion ist reversibel. Das bei der der anaeroben Verbrennung, z.B. bei der Muskelkontraktion, gebildete Lactat kann durch LDH wieder zu Pyruvat oxidiert werden.
|
Das Enzym ist ein Tetramer, das aus zwei unterschiedlichen Polypeptidketten (H und M) zusammengesetzt ist. Diese Untereinheiten können sich in unterschiedlicher Weise miteinander verbinden, so dass 5 Isoenzyme entstehen können: diese werden H4, H3M, H2M2, HM3 und M4 genannt. H-Ketten dominieren im Herzmuskel, während M-Isoformen hauptsächlich im Skelettmuskel vorkommen. Die einzelnen Ketten haben eine unterschiedliche Affinität zu ihrem Coenzym NADH, die Affinität der H-Ketten ist dabei 5-mal höher als die der M-Ketten.
Interaktive 3D-Ansicht eines LDH-Dimers |
Interaktive 3D-Ansicht von LDH und Liganden |
|
|
|
| Abb: Zwei Untereinheiten (rot und weiß) der LDH mit gebundenem Coenzym NAD | Abb.: Eine M-Untereinheit der LDH mit gebundenem Substrat Pyruvat und Coenzym NAD |
Die unterschiedliche Affinität macht man sich in der Auftrennung der 5 Isozyme der Lactat-Dehydrogenase durch Affinitätschromatographie zu Nutze. Dabei besteht die Affinitätsmatrix aus AMP (halbes NADH-Molekül)
Auftrennung der Isoformen der LDH: H4 - H3M - H2M2 - HM3 - M4
|
In der Affinitätschromatographie wird allmählich die Konzentration des durch die Säule fließenden Coenzyms NADH erhöht. Die LDH Isoformen lösen sich aufgrund ihrer unterschiedlichen Affinität zu ihrem Coenzym von der Matrix der Säule ab; Isoformen mit niederer Affinität trennen sich früher (und werden deshalb früher eluiert), als Isoformen mit höherer Affinität, die stärker an der Säulenmatrix haften und sich erst bei höheren NADH-Konzentrationen ablösen. LDH-Isoformen mit hochaffinen H-Ketten lösen sich also desto später, je höher der H-Kettenanteil im Gesamtmolekül ist. |
© Dr. Sabine Bieg, Univ. Mainz