Für die chemischen Eigenschaften von Atomen ist die Struktur der Elektronenhülle
entscheidend.
Wenn man Elektronen aus der Atomhülle entfernt oder hinzufügt,
bilden sich Ionen. Kationen sind positiv geladene Ionen, die durch
Abgabe von Elektronen entstehen. Anionen sind negative geladene Ionen; sie
entstehen durch Aufnahme von Elektronen.
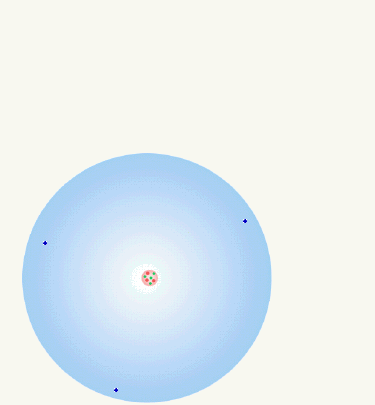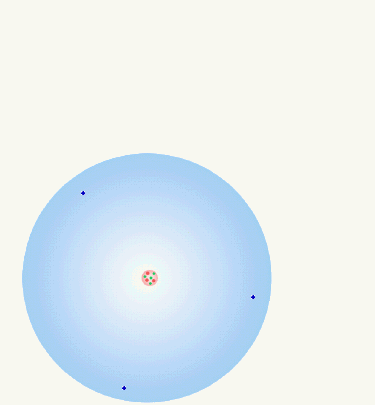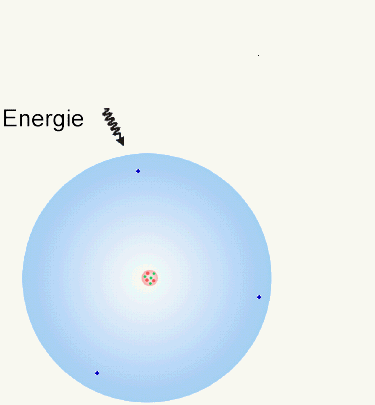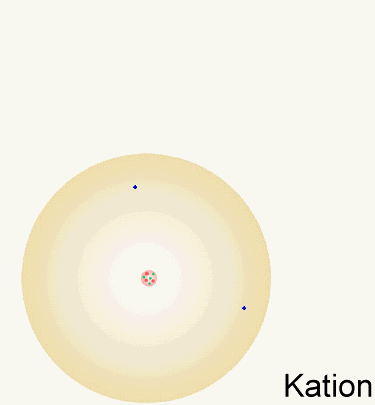
Da sich die Protonen und Elektronen in einem Atom gegenseitig mit ihren Anziehungskräften
beeinflussen, muß also Energie aufgewendet werden, um ein Elektron aus
einem Atom zu entfernen. Das ist die sogenannte Ionisierungsenergie.
Die Elektronegativität ist die Fähigkeit der Atome innerhalb
eines Moleküls die gemeinsamen Elektronen unterschiedlich stark anzuziehen.
Das bedeutet, daß Elektronen in einem Molekül eine höhere
Aufenthaltswahrscheinlichkeit in der Nähe des Kerns mit höherer
Elektronegativität haben.
Die Elektronegativität kann Werte zwischen 0 und 4,0 annehmen.











