Amine können leicht protoniert werden, sie reagieren daher basisch:
R–NH2 + H2O ®
R–NH3+ + OH–
Die meisten Amine sind sogar basischer als Ammoniak, ihr pKB-Wert ist größer.
Ursache hierfür ist der induktive Effekt der Alkylgruppe. Das an den Stickstoff
gebundene Kohlenstoffatom besitzt mehr Elektronen als ein Wasserstoffatom und kann daher eine
positive Ladung besser ausgleichen. Anilin und andere aromatische Amine reagieren jedoch weniger
basisch, da das freie Elektronenpaar am Stickstoff im p-System delokalisiert wird und sich dadurch
nicht so leicht ein Proton anlagern kann.
| |
Alkylamin
(Methylamin) |
> |
Ammoniak |
> |
Arylamin
(Anilin) |
| |
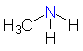 |
|
NH3 |
|
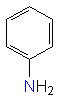 |
| pKB |
3,34 |
> |
4,75 |
> |
9,37 |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

