Die Reaktionsenthalpie (DH) gibt an, ob ein Prozeß exotherm oder
endotherm abläuft. Sie sagt jedoch nichts darüber aus, ob die Reaktion freiwillig abläuft.
Es gibt zahlreiche endotherme Reaktionen, die spontan ablaufen, wobei sich das Reaktionsgemisch
abkühlt.
Die Triebkraft einer Reaktion wird von der Gibbs freien Enthalpie (DG)
angegeben. Sie wird über die Gibbs-Helmholtz-Gleichung:
DG =
DH – T·DS
aus der Enthalpie und der Entropie (DS) berechnet. Der Einfluß der
Entropie wird dabei von der Temperatur mit bestimmt. Eine Reaktion läuft freiwillig ab, wenn
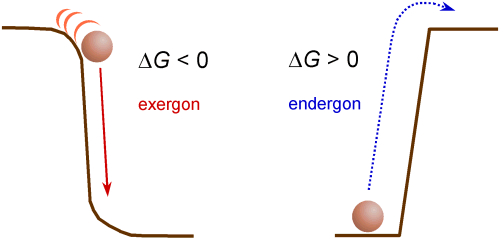
DG < 0 ist = exergone Reaktion. Ist
DG > 0 bezeichnet man die Reaktion als endergon.
T bezeichnet in der Thermodynamik stets die absolute Temperatur,
gemessen in Kelvin (K). Sie wird bezogen auf den absoluten Nullpunkt bei –273°C = 0 K.
Somit erhält man für 0°C = 273 K
 Übungsaufgabe zur Gibbs freien Enthalpie
Übungsaufgabe zur Gibbs freien Enthalpie


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie