Da Elektronen in einem Atom nicht alle die gleiche Energie besitzen, müssen
Möglichkeiten gefunden werden, dies zu beschreiben.
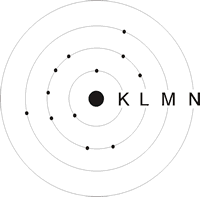
Im Bohrschen Atommodell werden die Elektronen auf unterschiedliche Energieniveaus
(Schalen) gesetzt, welche von innen nach außen mit den Buchstaben K,
L, M, N, O, P, Q gekennzeichnet werden. Wenn man die Schalen durchnumeriert
(1–7), erhält man die Hauptquantenzahl n.
Die Schalen können immer nur mit einer bestimmten Anzahl Elektronen besetzt
werden; die Anzahl läßt sich mit der Formel 2 · n2
berechnen
 |
|
Schale
|
Hauptquantenzahl
|
maximal mögliche
Elektronenzahl
|
| K |
1 |
2 |
| L |
2 |
8 |
| M |
3 |
18 |
| N |
4 |
32 |
| ... |
... |
... |
|
Die innere Schale muss immer erst voll besetzt sein, bevor die nächsthöhere
Schale besetzt werden kann.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
