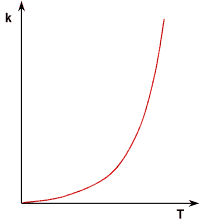
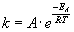Die Reaktionsgeschwindigkeit steigt mit zunehmender Temperatur. Bei höherer Temperatur besitzen die
Teilchen (im Mittel) mehr Energie, sie können somit leichter den "Aktivierungsberg"
überwinden. Die temperaturabhängige Größe ist die Geschwindigkeitskonstante
k. Sie wächst bei steigender Temperatur exponentiell. Der Zusammenhang wird
in der Arrhenius-Gleichung dargestellt:
A bezeichnet in der Gleichung eine Konstante, die nicht von der Temperatur abhängt.
Die Arrhenius-Gleichung zeigt auch den Einfluß der Aktivierungsenergie EA
auf die Reaktionsgeschwindigkeit. Da sie mit negativem Vorzeichen im Exponenten steht,
wird die Geschwindigkeitskonstante kleiner, wenn die Aktivierungsenergie zunimmt und
umgekehrt.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie