Werden zwei unterschiedlich konzentrierte Lösungen durch eine Membran
getrennt, die nur für das Lösungsmittel durchlässig ist, kommt es zur Osmose.
In den beiden nebenstehenden Grafiken ist dieser Vorgang schematisch dargestellt:
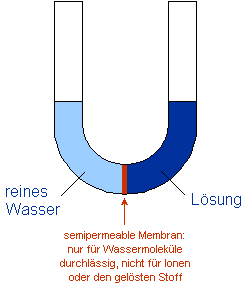
(1) Im U-Rohr befindet sich rechts von der Membran eine konzentrierte Lösung, links davon reines
Lösungsmittel. Ein Angleichen der Konzentrationen ist nur möglich, indem das
Lösungsmittel in die konzentrierte Lösung diffundiert. Dadurch nimmt
das Volumen der Lösung zu, das des reinen Lösungsmittels ab. (2) Die Steighöhe
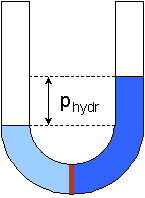
in den beiden Schenkeln des U-Rohres unterscheidet sich. Durch die Gewichtskraft baut sich bei
zunehmender Höhendifferenz ein hydrostatischer Druck auf, der schließlich
ein weiteres Eindiffundieren von Lösungsmittel verhindert. Diese Druckdifferenz
bezeichnet man als osmotischen Druck.
|
(1)
Ausgangssituation
 |
 |
(2)
Auswirkung der Osmose
 |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie


