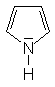| Porphyrine |
 |
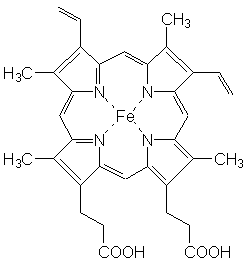 |
Die Häm-Gruppe besteht aus vier Pyrrol-Ringen, die jeweils über
eine CH2-Gruppe verküpft sind. Diese Baugruppe wird als
Porphyrin-System bezeichnet. Die Stickstoff-Atome wirken als Komplex-Liganden,
im Zentrum ist ein Eisen-Ion eingelagert.
Außen am Molekül sind zusätzlich einige Substituenten gebunden,
die je nach Art des Häms variieren können.
Die abgebildete Häm-Gruppe findet sich im
Hämoglobin.
Cytochrome enthalten sehr ähnliche Häm-Systeme.
Den Porphyrin-Systemen ähnliche Komplexbildner treten beispielsweise
beim Chlorophyll und beim
Cobalamin auf. |
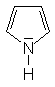
Pyrrol |
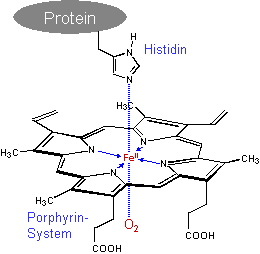 |
Eisen bildet oktaedrische Komplexe. Im Häm-Komplex werden die vier
äquatorialen Positionen durch das Porphyrin-System besetzt.
Die zwei axialen Positionen sind frei. Beim Hämoglobin ist der Imidazol-Ring
eines Histidins aus der Proteinkette an das Eisen koordiniert, die letzte freie
Position kann durch ein Sauerstoff- oder ein Wassermolekül besetzt werden.
Bei den Cytochromen, die als Redox-Systeme dienen, werden beide axialen
Koordinationsstellen am Eisen-Komplex durch Seitenketten aus dem Protein besetzt. |
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Mon Sep 29 15:41:02 2003 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie