Die Atmungskette bildet den Abschluß der biochemischen Energiegewinnung. In diesem Prozeß
werden die bei der Glycolyse und dem Citrat-Zyklus reduzierten Coenzyme NADH
und FADH2 wieder
oxidiert. Als Oxidationsmittel dient letztlich Sauerstoff. Die Energie wird als ATP,
also in einer biochemisch verwertbaren Form gewonnen.
Aus einem Mol Glucose entstehen 36-38 Mol ATP. 2 Mol ATP werden bei der Glycolyse
gewonnen, 2 Mol im Citrat-Zyklus. Die übrigen 32/34 Mol entstehen erst in der
Atmungskette.
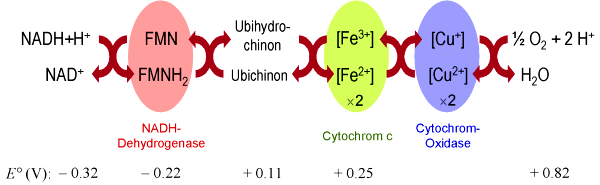
Die Oxidation erfolgt in der Atmungskette über eine Kaskade verschiedener Redox-Systeme.
Es sind insgesamt vier Enzymkomplexe für die Oxidation und ein Komplex für die
ATP-Synthese an diesem Prozeß beteiligt. Die gesamte Atmungskette läuft an der
inneren Mitochondrien-Membran ab.
Als Redoxsysteme dienen im einzelnen Schwermetallkomplexe, insbesondere Eisen-Porphyrin-Komplexe
(Cytochrome) und Kupferkomplexe, sowie
heterocyclische aromatische Systeme (z.B. FMN) und Chinone
(Ubichinon). Die einzelnen Redoxsysteme besitzen
Potentiale, die zwischen dem von NADH (-0,32 V) und dem von Sauerstoff (+0,82 V)
liegen. (Die Potentiale sind hier auf pH 7 bezogen!)
Während einiger Redox-Teilschritte werden Protonen aus dem Inneren des
Mitochondriums in den Intermembranraum zwischen innerer und äußerer
Mitochondrien-Membran transportiert. Dieser Protonengradient wird schließlich zur
ATP-Synthese ausgenutzt.
| Energie-Bilanz: |
Potentialdifferenz: |
DE = 1,14 V |
|
| |
theoretische Energieausbeute: |
DG = – z · F · DE |
DG = –220,0 kJ/mol |
| |
Energieinhalt von 1 Mol ATP
(ATP ® ADP + P) |
DG = – 30,5 kJ/mol |
|
| |
aus 1 Mol NADH entstehen 3 Mol ATP: |
DG = 3 · – 30,5 kJ/mol |
DG = – 91,5 kJ/mol |
| |
Gesamt-Energieausbeute: |
– 91,5 kJ/mol / –220,0 kJ/mol |
= 41,6% |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie