| Phosphorsäure dissoziiert über drei Stufen:
|
| H3PO4
+ H2O |
|
H2PO4– + H3O+ |
|
pKS1 = 2,0 |
| H2PO4–
+ H2O |
|
HPO42–
+ H3O+ |
|
pKS2 = 7,2 |
| HPO42–
+ H2O |
|
PO43–
+ H3O+ |
|
pKS3 = 12,3 |
Die pK-Werte machen deutlich, dass die Protonenabgabe nach jeder Stufe schwieriger
wird. H3PO4 ist eine mittelstarke Säure, während
H2PO4– eine schwache und HPO42–
eine sehr schwache Säure ist. Entsprechend sind die Plateaus der Titrationskurve
verteilt.
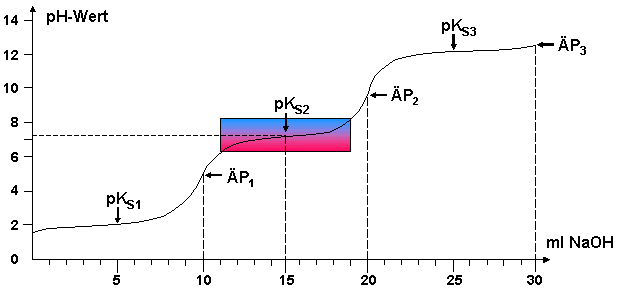 |
| Titrationskurve von 10 ml 0,1 M Phosphorsäure
titriert mit 0,1 M NaOH. Im pH-Bereich des Farbverlaufs Puffern die Spezies
H2PO4–/HPO42– |
Zu Beginn der Titration liegt der pH bei 1,5. Die Lösung enthält
fast nur die Spezies H3PO4 und H2PO4–.
Durch die Zugabe der Natronlauge werden sukzessive die H3PO4-Moleküle
in H2PO4–-Ionen überführt,
bis beim ersten Äquivalenzpunkt (ÄP1) fast nur noch H2PO4–-Ionen
vorliegen. Beim zweiten Äquivalenzpunkt (ÄP2) liegen
nur noch HPO42–-Ionen vor und beim dritten (ÄP3)
nur noch PO43–, wobei der dritte Äquivalenzpunkt
keine markante Steigung aufweist, weil er in den pH-Bereich des Titrationsmittels
fällt (0,1 M NaOH hat einen pH-Wert von 13). Das Plateau im Bereich
des pKS2 basiert auf der Pufferung durch das konjugierte Säure-Base-Paar
H2PO4–/HPO42–.
In der Praxis wird der Phosphatpuffer häufig verwendet, um neutrale pH-Bereiche
einzustellen, denn nach pH = pKS ± 1
liegt der Pufferbereich zwischen pH 6,2 und 8,2.
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:59 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
