| Titration
einer schwachen Säure |
| Die Titrationskurve einer schwachen Säure mit einer starken Base unterscheidet
sich von der Titrationskurve einer starken Säure gleicher Konzentration. |
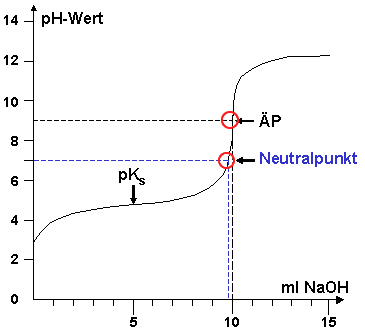 |
Titrationskurve von 10 ml Essigsäure mit
0,1 M NaOH ®
[CH3COOH]0 = 0,1 M
|
| 1. |
Der Anfangs-pH liegt höher als bei einer starken Säure, denn
nur ein geringer Anteil der Säure liegt dissoziiert vor. In unserem
Beispiel mit 0,1 M CH3COOH liegt der Anfangs-pH bei 2,9 (pH = 1/2·(pKs - log [HA]0)
= 1/2·(4,8 + 1)). |
| 2. |
Im Bereich des pK-Wertes der Essigsäure verläuft die Titrationskurve
flach. Das zugegebene Titrationsmittel wird fortlaufend verbraucht, um
Essigsäure in Acetat-Ionen zu überführen. |
| 3. |
Der Äquivalenzpunkt fällt nicht mehr mit dem Neutralpunkt
zusammen. Der pH am ÄP entspricht dem einer Lösung von 0,001 mol
Natriumacetat (n = c·V = 0,1 mol/l·0,01 l) in 20 ml Wasser (Volumen
der Lösung nach Zugabe von 10 ml Titrationsmittel). Die Acetatkonzentration
ist dann c = 0,001 mol / 0,02 l = 0,05 und der pH-Wert lässt sich
über die Formel für schwache Basen bestimmen:
pH = 14 - 1/2·(pKb - log [B]0)
= 14 - 1/2·(9,2 - log 0,05) = 8,7.
Der Umschlagspunkt des Indikators muss hier zwischen pH 8 und 10 liegen.
Würde man einen Indikator mit Umschlagsbereich um pH 5 verwenden,
wäre der Fehler im Gegensatz zur Titration einer starken Säure
nicht mehr zu vernachlässigen. |
In analoger Weise kann man auch eine schwache Base mit einer starken Säure
titrieren. Die Titrationskurve beginnt dann im basischen Bereich, und beim
Äquivalenzpunkt liegt der pH-Wert unter 7.
Bei mehrprotonigen Säuren ist die Anzahl der abspaltbaren Protonen zu
berücksichtigen. Die Titrationskurve hat dann auch mehrere Äquivalenzpunkte
(z.B. Phosphorsäure oder Kohlensäure).
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:56 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
