Chemische Reaktivität
Ladungsverteilung
Kohlenstoff- und Wasserstoffatome haben eine ähnliche elektronenanziehende Kraft, wodurch Kohlenwasserstoffe eine gleichmäßige Elektronendichteverteilung und somit keine Polarität besitzen. Heteroatome wie Sauerstoff, Stickstoff oder die Halogene haben im Gegensatz dazu eine größere elektronenanziehende Wirkung. D.h. sie haben eine höhere Elektronegativität wodurch organische Verbindungen polarisiert werden. Diese Vorstellung wird durch ein einfaches Symbol, der (negativen) Partialladung, am entsprechenden Atom ausgedrückt. Metallatome sind dagegen weniger elektronegativ als Kohlenstoffatome und stellen Elektronendichte zur Verfügung. Das benachbarte Kohlenstoffatom bekommt dadurch eine negative Partialladung. Molekülatome mit Stellen hoher Elektronendichte (Nukleophile) reagieren mit den Atomen in Verbindungen mit niedriger Elektronendichte (Elektrophile) und umgekehrt.
Dieses wichtige Konzept, welches Jahrzehnte zum Erklären der chemischen Reaktivität und der Reaktionsmechansimen genutzt wurde, ist nur von quantitativer Natur. Erst quantenmechanische Methoden bzw. empirische Verfahren ordneten den Partialladungen der Atome in einem Molekül Werte zu.
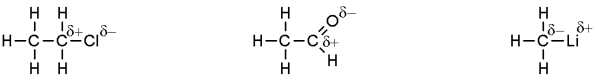
Ladungsverteilung
© Prof. Dr. J. Gasteiger, Dr. Th. Engel, CCC Univ. Erlangen, Wed Mar 10 08:08:36 2004 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
