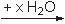Beim Lösungsvorgang werden die Ionen hydratisiert, sie erhalten eine Hülle aus Wassermolekülen.
Diese Hydrathülle ist aus mehreren Schichten aufgebaut. Die Moleküle der innersten Hülle, bei
Natrium- und Chloridionen sind es 6 Moleküle, sind sehr fest gebunden. In Lösungen existieren keine
"nackten" Ionen. In Reaktionsgleichungen erhalten hydratisierte Ionen oft das Suffix "aq":
| NaCl |
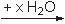 |
Na+aq + Cl–aq |
Aus der Hydratation resultiert auch ein größerer effektiver Ionenradius. Der Ionenradius beeinflußt
unter anderem die Diffusionsgeschwindigkeit und den Transport von Ionen durch Membranen.
| Ionenradius ohne Hydrathülle: |
Li+ |
< |
Na+ |
< |
K+ |
| Radius der hydratisierten Ionen: |
Li+aq |
> |
Na+aq |
> |
K+aq |
Kleinere Ionen (z.B. Li+) binden mehr Wassermoleküle als größere (K+)
und sind damit in hydratisierter Form größer.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie