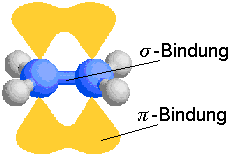
Wenn sp2- und sp-Hybridorbitale Bindungen eingehen, bilden sich s-Bindungen und
p-Bindungen aus.
p-Bindungen entstehen durch Überlappung der freien p-Orbitale.
Gehen zum Beispiel zwei C-Atome eine Doppelbindung ein, verbinden sich die jeweils freien Elektronen
im p-Orbital zu einem Elektronenpaar. Man nennt sie dann auch p-Elektronen.
Aufgrund der p-Bindungen sind C–C-Mehrfachbindungen nicht mehr um ihre eigene Achse drehbar.
© Prof. Dr. J. Gasteiger, A. Hofmann, CCC Univ. Erlangen, Fri Mar 30 11:41:17 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie