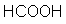| Substituenteneinflüsse auf die Acidität |
 |
Der pKs-Wert verschiedener Carbonsäuren schwankt zwischen
1 und 5. Die Unterschiede zwischen den einzelnen Carbonsäuren werden
durch die Substituenten des Restes bestimmt.

|
|
pKs |
|
|
pKs |
|

|
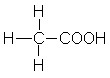 |
4,8 |
Essigsäure |
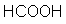 |
3,7 |
Ameisensäure |
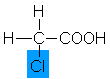 |
2,9 |
Chloressigsäure |
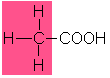 |
4,8 |
Essigsäure |
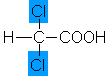 |
1,5 |
Dichloressigsäure |
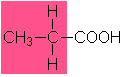 |
4,9 |
Propionsäure |
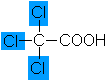 |
0,7 |
Trichloressigsäure |
|
|
|
Elektronenziehende Substituenten erhöhen die Acidität (–Cl,
–OH, –COOH, –F, –I). Elektronenabstossende Substituenten
erniedrigen die Acidität (–CH2–, –CH3).
Die Polarisierung der O–H-Bindung wird durch die Substituenten über
Einfachbindungen hinweg beeinflusst. Man spricht dann von einem induktiven
Effekt.
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Thu Apr 25 13:32:19 2002 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie