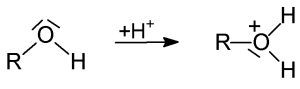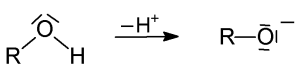| |
Methanol
CH3OH |
Ethan
C2H6 |
| Molare Masse |
32 |
30 |
| Siedepunkt |
65°C |
-89°C |
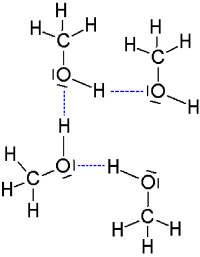
Als Beispiele sind hier die Siedepunkte von Methanol und Ethan angegeben. Die Molmassen sind
nahezu gleich, die Siedepunkte unterscheiden sich jedoch um 154 K. Ursache für den
deutlich höheren Siedepunkt des Alkohols ist, daß die Alkohol-Moleküle
Wasserstoffbrücken ausbilden können. Zwischen den unpolaren Alkan-Molekülen
ist dies nicht möglich.
An die freien Elektronenpaare am Sauerstoff der OH-Gruppe kann sich auch ein Proton
anlagern. Durch starke Basen kann andererseits die OH-Gruppe deprotoniert werden.
Alkohole weisen somit - wie Wasser auch - einen amphoteren Charakter auf.
Die Acidität der Alkohole ist jedoch sehr viel geringer, als die von Wasser.
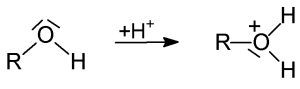 Protonierung eines Alkohols: Bildung eines Oxonium-Ions
Protonierung eines Alkohols: Bildung eines Oxonium-Ions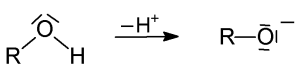 Deprotonierung eines Alkohols: Bildung eines Alkoholat-Ions
Deprotonierung eines Alkohols: Bildung eines Alkoholat-Ions


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie