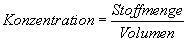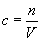Chemische Reaktionen werden oft in Lösung durchgeführt. Um die Reaktion quantitativ
beschreiben zu können, muß die Konzentration der jeweiligen Komponenten angegeben
werden.
Für Konzentrationsangaben sind verschiedene Maße in Gebrauch:
Der Massenanteil wird in Prozent angegeben:
Eine 1%ige NaCl-Lösung enthält 1 g NaCl in 100 g Lösung.
10%ige HCl bedeutet, in 100 g wässriger Salzsäure sind 10 g HCl gelöst.
Auch der Volumenanteil wird in Prozent angegeben, zur Unterscheidung wird
"vol" vorangestellt:
10 vol% Ethanol wird z.B. aus 100 ml Ethanol und 900 ml
Wasser hergestellt. Hierbei ändert sich die Dichte!
In der Chemie am gebräuchlichsten ist die Molarität.
Sie gibt an, wieviel Mol eines Stoffes in 1 Liter Lösung enthalten sind:
2 mol/l NaCl enthält also 2 Mol Kochsalz mit der molaren Masse 58,5 g
(Na: 23,0 g/mol + Cl: 35,5 g/mol), also 117,0 g NaCl in 1 Liter Lösung.
Die Molarität wird oft mit M abgekürzt: 2 M NaCl = 2 mol/l NaCl = zweimolare Kochsalzlösung
 Physikum-Frage zur Konzentration
Physikum-Frage zur Konzentration


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie