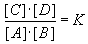Die Reaktionsgleichung beschreibt den Brutto-Umsatz bei einer chemischen Reaktion.
Mit ihrer Hilfe können Stoffumsätze berechnet werden.
Kann eine Reaktion in beide Richtungen ablaufen, stellt sich ein Gleichgewicht
ein. Die Lage des Gleichgewichtes wird durch das Massenwirkungsgesetz (MWG) beschrieben:
A + B  C + D
C + D
Die Gleichgewichtskonstante K ist charakteristisch für eine
Reaktion. Sie ist temperaturabhängig.
Gleichgewichte können durch Änderung der Temperatur, des Druckes oder
durch Entfernen eines Produktes verschoben werden.
In offenen Systemen können sich Fließgleichgewichte ausbilden.
Zur Aufrechterhaltung eines Fließgleichgewichtes muß Energie
zugeführt werden.
 Physikum-Fragen zu Chemischen Reaktionen
Physikum-Fragen zu Chemischen Reaktionen


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 C + D
C + D