Visualisierung molekularer Eigenschaften
Die Kenntnis der räumlichen Gestalt eines Moleküls reicht
im Allgemeinen nicht aus, um komplexe, molekulare Wechselwirkungen
zu verstehen. Vielmehr müssen molekulare Eigenschaften wie
beispielsweise das elektrostatische Potential, hydrophile Eigenschaften
oder auch Fähigkeiten zur Ausbildung von Wasserstoffbrücken
mit in Betracht gezogen werden. Dabei kann zwischen drei Eigenschaftskategorien
unterschieden werden: skalare (Iso-Oberflächen), vektorielle
und volumetrische Eigenschaften.
Um Eigenschaften auf Moleküloberflächen abzubilden, werden
zwei unterschiedliche Ansätze verfolgt. Im ersten Fall wird
den einzelnen Gitternetzpunkten der Oberfläche ein entsprechender
Farbwert zugewiesen. Durch eine nachfolgende Interpolation der Farbwerte
beim Verbinden der Gitterpunkte (Meshes) zu Linien (Gitternetz
bzw. Chicken Wire) oder ganzen Flächen (Solid Sphere)
ergibt sich eine Oberfläche mit einem kontinuierlichen Farbverlauf.
Alternativ zu diesem Ansatz können auch farbige Texturen auf
der Oberfläche abgebildet werden, was meist dazu benutzt wird,
um Eigenschaften wie z.B. elektrostatisches Potential, Polarisierbarkeit,
Hydrophobizität und Spindichte anzuzeigen.
Iso-Wert basierte (skalare) Eigenschaften
Neben den Molekülorbitalen können auch andere molekulare
Eigenschaften wie das elektrostatische Potential oder die
Spindichte mit Hilfe von Isowert-Oberflächen dargestellt
werden. Im Regelfall werden diese skalaren Eigenschaften auf unterschiedlichen
Oberflächen (SAS, SES, etc.) abgebildet. Diese Art der hochdimensionalen
Visualisierung erlaubt eine schnelle und leichte Identifikation
der relevanten Molekülregionen.
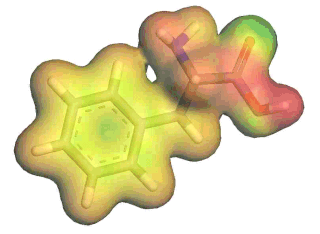
Eine typische Darstellung des elektrostatischen
Potentials von Phenylalanin auf einer Moleküloberfläch
Molekülorbitale
Molekülorbitale waren die ersten elektronischen Eigenschaften,
die mit Hilfe einfacher graphischer Hardware visualisiert wurden.
Der Grund für diese frühe, graphische Repräsentation
beruht auf den schwer zugänglichen,
mathematischen Grundlagen der Quantenchemie,
die mit Hilfe der graphischen Darstellung wesentlich schneller erfasst
und verstanden werden können, als durch eine Sammlung numerischer
Orbitalkoeffizienten. Die durch semi-empirische oder ab-initio
quantenmechanischen Verfahren generierten Molekülorbitale werden
durch Iso-Oberflächen dargestellt - analog den Elektronendichte-Oberflächen.
|
Die Kenntnis der Molekülorbitale, besonders des HOMO
(Highest Occupied Molecular Orbital) und des LUMO (Lowest
Unoccupied Molecular Orbital), vermittelt ein besseres Verständnis
von Reaktionen. Orbitalanteile, die auf unterschiedliche Vorzeichen
der Wellenfunktion basieren, werden dabei häufig durch
unterschiedliche Farben (z.B. rot und blau) repräsentiert.
http://www2.chemie.uni-erlangen.de/services/orbvis/index.html
|
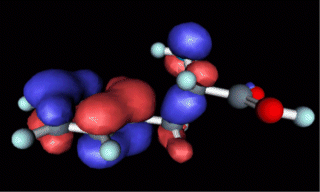
Darstellung der Phenylalanin-Molekülorbitale
(HOMO, LUMO)
|
Elektrostatische Potential
|

Die Darstellung des molekularen elektrostatischen
Potentials von Phenylalanin als Iso-Oberfläche. Punkte
auf den blauen bzw. roten Flächen besitzen das gleiche
Potential (Energiewert)
|
Das molekulare elektrostatische Potential (MEP) wurde als
erstes von Bonaccorsi et al. definiert und ist unbestritten
die wichtigste und meistgenutzte Eigenschaft molekularer Oberflächen.
Mit Hilfe des elektrostatischen Potentials lassen sich leicht
molekulare Regionen ermitteln, die für die Reaktivität
einer Verbindung eine große Bedeutung haben. Darüber
hinaus spielt das MEP auch bei der Bildung von Protein-Ligand-Komplexen
eine entscheidende Rolle.
http://www2.chemie.uni-erlangen.de/services/molsurf/
|
Polarisierbarkeit und Hydrophobizität
Diese Eigenschaften spielen ebenfalls eine relevante Rolle bei
der Betrachtung molekularer Wechselwirkungen. Im Gegensatz zum elektrostatischen
Potential kommen diese Eigenschaften jedoch erst bei kleinen Abständen
zwischen interagierenden Molekülregionen zum Tragen.
Spindichte
Die Spindichte ist vor allem für die Betrachtung von Radikalen
von Bedeutung, da durch die Visualisierung dieser Eigenschaft ungepaarte
Elektronen schnell lokalisiert werden können.
Vektorielle Eigenschaften
Molekulare Eigenschaften lassen sich, im Fall von skalarbasierten
Werten, auf Moleküloberflächen abbilden. Für die
Visualisierung vektorieller Eigenschaften wie z.B. dem elektrischen
Feld eines Moleküls oder der potentiellen Ausrichtung einer
Wasserstoffbrücken-Bindung müssen alternative Darstellungsverfahren
angewendet werden. Gerichtete Eigenschaften werden dabei in der
Regel durch räumliche ausgerichtete Kegel oder durch Feldlinien
repräsentiert.
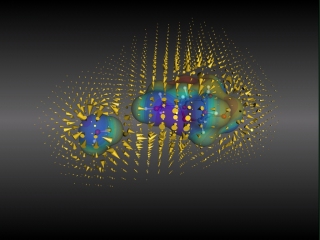

Molekulare Oberfläche eines Glucose- und
eines Wassermoleküls auf denen das elektrostatische Potential
projiziert wird. Außerdem sind die Vektoren des elektrischen
Felds, welches die Moleküle umgibt, einmal durch kleine Kegel
und zum anderen durch Feldlinien dargestellt.
Volumenbezogene Eigengenschaften
Die Visualisierung volumenbezogener Daten spielt vor allem in anderen
wissenschaftlichen Disziplinen wie in der Medizin (z.B. Computertomographie)
oder der Geologie (z.B. Konvektionsströme) eine bedeutende
Rolle. Allerdings finden sich auch in der Chemie einige Anwendungsgebiete
für diese Darstellung. Stellvertretend für die Klasse
von Eigenschaften sei hier nur die Wasserdichteverteilung bei Moleküldynamiken
erwähnt. Die computergestützte Visualisierung dieser Daten
wird im Allgemeinen durch zwei- oder dreidimensionale Texturen realisiert.
http://www2.chemie.uni-erlangen.de/services/emvis/emvis.html
© Prof. Dr. J. Gasteiger, Dr. Th. Engel, CCC Univ. Erlangen, Thu Dec 18 14:53:54 2003 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie




