Van der Waals-Oberfläche
Die van der Waals-Moleküloberfläche kann sehr einfach
aus den van der Waals-Radien aller Atome bestimmt werden. Der van
der Waals-Radius wiederum, gibt den Abstand an, auf welchen sich
nicht gebundenen Atome annähern können. In der dreidimensionalen
Darstellung wird dieser Raumbedarf als Kugelsphäre angegeben
(Space-Filling-Modell) .
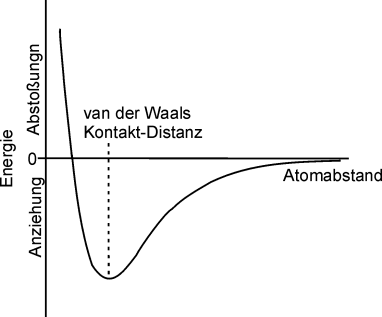 |
Die Abhängigkeit der van der Waals-Energie von der Distanz
zwischen nicht gebundenen Atomkernen. Mit abnehmenden Atomabstand
ziehen sich die Kerne an bis die Energie wieder ansteigt. Am
Minimum wird der van der Waals-Radius erreicht. |
Im Molekül durchdringen sich die Sphären der van der
Waals-Radien aller gebundenen Atome. Im nächsten Schritt werden
alle Atomsphären verschmolzen.
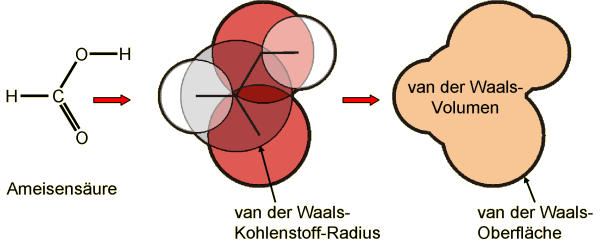
Schnitt durch das 3D Modell von Ameisensäure.
Die van der Waals-Oberfläche wird durch Verbinden aller Atom-Sphären
erhalten, die wiederum durch die einzelnen van der Waals-Radien
erzeugt werden.
Der Raum innerhalb dieser verschmolzenen Sphären wird als
van der Waals-Volumen bezeichnet und die Umhüllende der Sphären
definiert die van der Waals-Oberfläche des Moleküls. Diese
kann leicht und schnell berechnet werden.
© Prof. Dr. J. Gasteiger, Dr. Th. Engel, CCC Univ. Erlangen, Thu Dec 18 14:53:54 2003 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

