Besonders starke Dipole bilden sich bei Molekülen aus, in denen Wasserstoff
an die Elemente N, O und F gebunden ist.
Das stark positiv polarisierte Wasserstoffatom tritt dann in Wechselwirkung mit
einem freien Elektronenpaar eines Nachbarmoleküls. Dieser Bindungstyp
wird Wasserstoffbrücken-Bindung genannt und ist von enormer Bedeutung
für Struktur und Funktion von Biopolymeren wie DNA, Proteine und Polysaccharide.
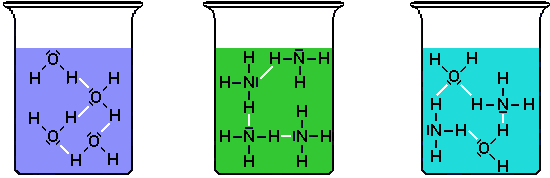
|
Wasserstoffbrücken-Bindungen zwischen H2O,
NH3 bzw. in einem H2O-NH3-Gemisch
(Man beachte: NH3 siedet bei -33°C, ist also bei Raumtemperatur nicht flüssig) |
Die Stärke der Wasserstoffbrückenbindungen kann an den Siedepunkten von
Ammoniak (NH3), Wasser (H2O) und Methan (CH4) aufgezeigt werden:
| Molekül |
Molmasse |
Siedepunkt |
| CH4 |
16,0 |
-161°C |
| NH3 |
17,1 |
-33°C |
| H2O |
18,0 |
100°C |
Dipol-Dipol-Kräfte: Diese beruhen auf der Wechselwirkung von
Molekülen, die ein permanentes Dipolmoment besitzen, wie z.B. Methylchlorid (CH3Cl) oder Salzsäure
(HCl). Die Kräfte sind geringer als die der Wasserstoffbrücken-Bindung.
 |
MC-Frage zur Wasserstoffbrückenbindung |


