Weichen die Elektronen eines Atoms für kurze Zeit von der Normallage
ab, dann besitzt das Molekül ein momentanes Dipolmoment, welches in den Atomen
eines Nachbarmoleküls ebenfalls ein momentanes Dipolmoment induziert. Vorübergehend
bilden sich Regionen mit erhöhter oder erniedrigter Elektronendichte, was
zu einer elektrostatischen Anziehung der Moleküle führt.
Diese Wechselwirkungen werden als van der Waals-Kräfte bezeichnet.
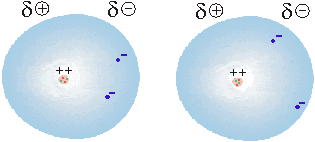 |
Schematische Darstellung vorübergehend polarisierter Atome
Der Effekt ist umso stärker, je größer die Elektronenhülle ist. |
Die van der Waals-Kraft nimmt mit der Oberfläche der Moleküle zu.
Ein schönes Beispiel bietet der Vergleich der Siedepunkte des
n-Pentan und des 2,2-Dimethylpropan (Neopentan).
Beide Moleküle haben die gleiche molare Masse, aber eine ganz andere Form.
Weil das langgestreckte n-Pentan eine viel größere Oberfläche hat, um mit
den Nachbarmolekülen in Wechselwirkung zu treten, liegt der Siedepunkt um 27 °C höher
als der des kugelförmigen Neopentans.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
