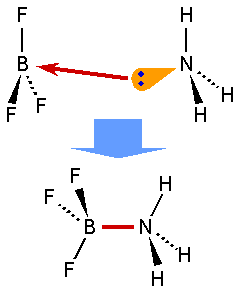
Bei Metallkomplexen tritt ein neuer Bindungstyp auf: die koordinative Bindung.
Bei der Ausbildung einer kovalenten Bindung steuert jeder Bindungspartner ein
Elektron zum Bindungs-Elektronenpaar bei. Für die koordinative Bindung werden beide
Elektronen von einem Bindungspartner geliefert. Zu koordinativen Bindungen kommt
es daher nur, wenn ein Partner ein freies Elektronenpaar besitzt und der andere
Partner eine "Elektronenlücke" aufweist. Die freien Elektronen fließen
in die Elektronenlücke, die koordinative Bindung wird dadurch geknüpft.
Die Grafik zeigt als Beispiel für die Ausbildung einer koordinativen Bindung
die Reaktion von Bortrifluorid mit Ammoniak.
Auch die Protonierung von Wasser oder Ammoniak läuft unter Bildung einer
koordinativen Bildung ab:
H+ + H2O ® H3O+
H+ + :NH3 ® NH4+
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie