Eine Verschiebung des Gleichgewichtes ist - vor allem bei Reaktionen in der Gasphase - auch durch
Änderung des Druckes möglich. Betrachten wir als Beispiel die Dimerisierung von NO2:
2 NO2  N2O4
N2O4
Bei der Reaktion ändert sich die Teilchenzahl. In einem geschlossenen System mit konstantem Volumen
verringert sich zunächst der Druck, wenn NO2 dimerisiert. Sobald sich das Gleichgewicht
eingestellt hat, bleiben die Konzentrationen von NO2 und N2O4 konstant
und damit auch der Druck.
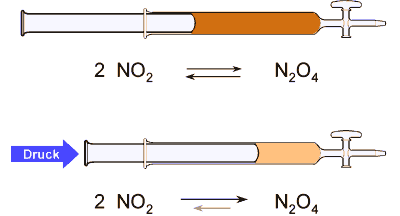
NO2 ist dunkelbraun gefärbt, N2O4 ist farblos. Die Farbe ist daher
ein Maß für die Lage des Gleichgewichts. Je dunkler das Gasgemisch gefärbt ist, desto
weiter liegt das Gleichgewicht auf der Seite des Eduktes, wäre das Gas farblos, läge reines
Produkt (N2O4) vor.
Wird von außen der Druck erhöht, beeinflußt man damit die Lage des Gleichgewichts.
Die Reaktion wird in Richtung Produkt verschoben, da hierbei die Teilchenzahl und damit das Volumen
abnimmt. Das Gasgemisch wird heller.
Das Ausweichen des Gleichgewichts bei Druckerhöhung nennt man Prinzip des kleinsten
Zwangs. Es tritt in ähnlicher Form auch bei Temperaturänderungen ein. Dieses Prinzip
wurde 1887 von H. L. Le Châtelier und K. F. Braun formuliert und später nach
den Entdeckern benannt:
»Das Gleichgewicht verschiebt sich stets so, daß es dem äußeren
Zwang ausweicht.«


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 N2O4
N2O4