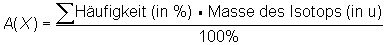Die meisten Elemente bestehen aus mehreren Isotopen, die mit
unterschiedlicher Häufigkeit auftreten. Da diese Zusammensetzung aus
Isotopen in der Natur konstant ist, kann man für die natürlich
vorkommenden Elemente die Isotopenhäufigkeit angeben.
Die relative Atommasse wird deshalb unter Berücksichtigung
der Isotopenhäufigkeit errechnet.
Nimmt man nun genau 12 g des Kohlenstoff Isotops 12C und teilt
durch die absolute Masse erhält man die Teilchenzahl. Sie wird Avogadro-Konstante
NA (oder Loschmidtzahl) genannt und bildet die Grundlage
für die Stoffmenge n.
NA = 6,02 · 1023 mol–1
Die Stoffmenge wird mit der Einheit mol angegeben. 1 mol eines Elementes
enthält also immer 6,02 · 1023 Atome; analog hat
1 mol einer chemischen Verbindung 6,02 · 1023 Moleküle.
Umgekehrt gilt dann auch, daß 1 mol eines Elementes soviel wiegt,
wie die entsprechende relative Atommasse in Gramm; 1 mol einer Verbindung
entspricht der Summe der Massen aller gebundenen Atome
(siehe Kap. Chemische Bindung).


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie