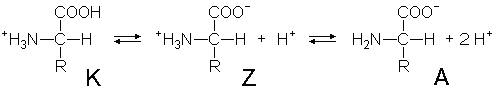Wird eine Aminosäure in Wasser gelöst, liegt sie hauptsächlich in der zwitterionischen Form (Z) vor. Diese steht im Gleichgewicht mit der
kationischen (K) und der anionischen Form (A) der Aminosäure. Gibt man zu dieser Lösung
Säure (H+), wird das Gleichgewicht "nach links", zur kationischen
Form verschoben. Bei Zugabe von Laugen werden die aus der Aminosäure freigesetzten
Protonen durch OH--Ionen neutralisiert und das Gleichgewicht auf die Seite der
Anionen ("nach rechts") verschoben.
Die Lage des Gleichgewichts kann durch das Massenwirkungsgesetz
beschrieben werden:
KS1 = [Z] [H+] / [K]
bzw. KS2 = [A] [H+] / [Z]
Durch Logarithmieren erhält man - unter Berücksichtigung, daß log10[H+]
= pH und log10(KS) = pKS - die Henderson-Hasselbalch-Gleichung:
pH = pKS1 + log [Z]/[K]
bzw. pH = pKS2 + log
[A]/[Z]
Bei einem bestimmten pH-Wert verhält sich die Aminosäure nach
außen neutral. Diesen pH-Wert nennt man isoelektrischen
Punkt (pHIP). Am isoelektrischen Punkt
liegt die Aminosäure weitgehend als Zwitterion vor und die
Konzentrationen von Kationen und Anionen sind gleich groß ([K] =
[A]).
Diese Überlegung läßt sich auch auf Peptide (und Proteine) übertragen. Bei Peptiden
können außer der terminalen COOH- und NH2-Gruppe auch Carboxyl- und
Aminogruppen der Aminosäure-Seitenketten dissoziieren. Die Peptide weisen an den
zugehörigen pKS-Werten Pufferwirkung auf. Auch für jedes Peptid (und Protein)
gibt es genau einen pH-Wert, an dem es ungeladen vorliegt, jedes
Peptid und Protein hat einen isoelektrischen Punkt!


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie