Salze sind Feststoffe, die aus Ionen bestehen. Sie haben sehr hohe Schmelzpunkte und bilden Ionenkristalle.
Ionen unterschiedlicher Ladung ziehen sich durch elektrostatische Kräfte gegenseitig an.
Diese Kräfte sind nicht gerichtet, d.h. sie wirken in der gesamten Umgebung eines Ions.
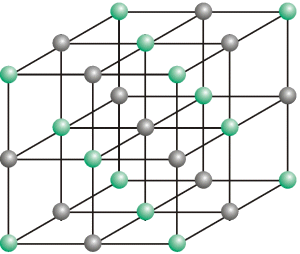
Dadurch bauen sich Ionengitter auf, in denen die Ionen in regelmäßiger Reihenfolge angeordnet sind.
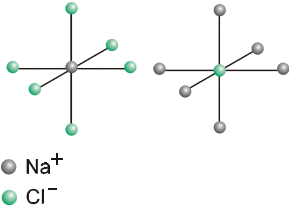
Im Beispiel des NaCl (siehe Bild) ist jedes Ion oktaedrisch von sechs entgegengesetzt geladenen Ionen umgeben.
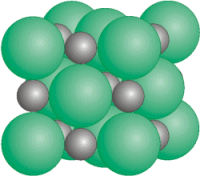
Unter Beachtung der Ionenradien hat man sich obiges NaCl-Kristallgitter also eher so vorzustellen:
 |
MC-Frage zur Ionenbindung |