Die Atome ändern bei Elektronenabgabe bzw. -aufnahme ihre Radien,
so daß man zwischen Atom- und Ionenradien unterscheiden muß.
Wenn ein Atom durch Elektronenabgabe ein Kation bildet, so verringert sich sein Radius,
da die Kernladung die restlichen Elektronen stärker anzieht.
Bei Aufnahme eines Elektrons (Anionenbildung) wird der Radius größer,
da durch die zusätzliche negative Ladung die Schale aufgeweitet wird.
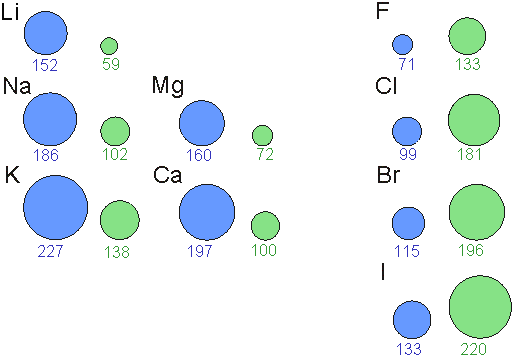 |
| Atom- (blau)
und Ionenradien (grün) einiger ausgewählter Elemente |
© Prof. Dr. J. Gasteiger, A. Hofmann, CCC Univ. Erlangen, Fri Mar 30 11:41:12 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
