|
|
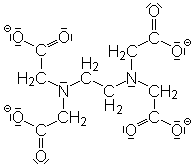
EDTA wird als Komplexbildner in unterschiedlichen Bereichen der Chemie, Biochemie und Medizin verwendet:
- In der Analytik werden EDTA-Lösungen zur titrimetrischen Bestimmung von Schwermetall-Konzentrationen
sowie zur Bestimmung der Wasserhärte verwendet.
- Die Blutgerinnung ist Calcium-abhängig. Durch Komplexierung der Ca2+-Ionen mittels
EDTA oder Citrat, kann die Gerinnung von Blutpräparaten verhindert werden.
- Bei Vergiftungen mit bestimmten Schwermetallen (vor allem Blei und Cadmium) kann EDTA gegeben werden.
Die Schwermetallionen werden komplexiert und können mit dem Urin ausgeschieden werden.
- In bestimmten (seltenen) Fällen ist es möglich, calciumreiche Nierensteine durch die
Gabe von EDTA aufzulösen.
Da EDTA insbesondere mit Calciumionen sehr stabile Komplexe bildet, darf dem Organismus nur mit
Ca2+ "beladenes" EDTA (meist kommt CaNa2EDTA zum Einsatz) gegeben werden,
sonst käme es zu massiven Störungen des Calciumhaushalts.
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie