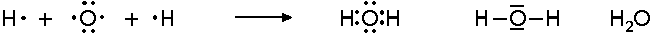Wieviele kovalente Bindungen ein Atom eingehen kann, hängt von der Anzahl der freien Valenzelektronen ab.
Fluor hat 7 Valenzelektronen, braucht also zur Erfüllung der Oktettregel ein weiteres Elektron.
Außerdem bilden 6 der 7 Elektronen freie Elektronenpaare und nur das siebte Elektron steht für
ein bindendes Elektronenpaar zur Verfügung; Fluor ist also einbindig.
Sauerstoff hat 6 Valenzelektronen und kann folgendermaßen reagieren:
Sauerstoff ist also aufgrund der 2 freien Valenzen zweibindig.
| Bindigkeit |
Atome |
Beispiele |
| einbindig |
Wasserstoff, Halogene |
HF, Cl2 |
| zweibindig |
Sauerstoff |
H2O |
| dreibindig |
Stickstoff |
NH3 |
| vierbindig |
Kohlenstoff |
CH4 |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie